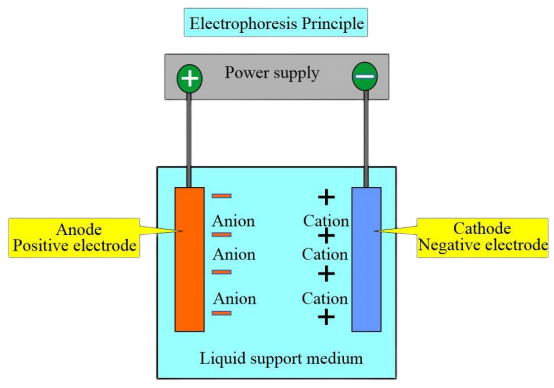
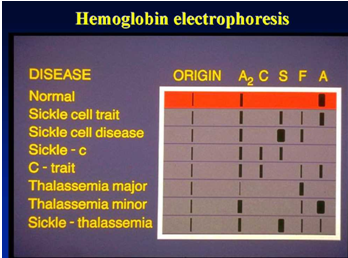
Zasada eksperymentu
Elektroforeza hemoglobiny ma na celu wykrycie i potwierdzenie różnych prawidłowych i nieprawidłowych hemoglobin.
Ze względu na różne ładunki i punkty izoelektryczne różnych typów hemoglobiny, w pewnym roztworze buforowym pH, gdy punkt izoelektryczny hemoglobiny jest niższy niż pH roztworu buforowego, hemoglobina przenosi ładunek ujemny i migruje w kierunku anody podczas elektroforezy. I odwrotnie, hemoglobina z ładunkiem dodatnim przemieszcza się w kierunku katody.
Pod pewnym napięciem i po określonym czasie elektroforezy hemoglobiny o różnym ładunku i masie cząsteczkowej wykazują różne kierunki i prędkości migracji. Pozwala to na oddzielenie odrębnych stref, a następnie na tych strefach można przeprowadzić kolorymetryczną lub elektroforetyczną analizę skaningową w celu ilościowego oznaczenia różnych hemoglobin. Najczęściej stosowaną metodą jest elektroforeza membranowa z octanem celulozy o pH 8,6.
W cytoplazmie grupy glikolu etylenowego (CHOH-CHOH) obecne w glikogenie lub substancjach polisacharydowych (takich jak mukopolisacharydy, mukoproteiny, glikoproteiny, glikolipidy itp.) są utleniane przez kwas nadjodowy i przekształcane w grupy aldehydowe (CHO-CHO). Te grupy aldehydowe łączą się z bezbarwnym, fioletowo-czerwonym odczynnikiem Schiffa, tworząc fioletowo-czerwony barwnik, który osadza się tam, gdzie w komórce obecne są polisacharydy. Reakcja ta znana jest jako barwienie kwasem nadjodowym Schiffa (PAS), wcześniej określane jako barwienie glikogenem.
Metoda eksperymentu
Przybory:Octan celulozypammembrana, aparat do elektroforezy(DYCP-38C i zasilacz DYY-6C), Doskonałe narzędzie do ładowania próbek (pipeta), spektrofotometr, kuwety kolorymetryczne, bufory.
Bufor:
(1) Bufor TEB o pH 8,6: Odważyć 10,29 g Tris, 0,6 g EDTA, 3,2 g kwasu borowego i dodać wodę destylowaną do 1000 ml.
(2) Bufor boranowy: Odważyć 6,87 g boraksu i 5,56 g kwasu borowego i dodać wodę destylowaną do 1000 ml.
Procedura:
Pnaprawa roztworu hemoglobiny
Weź 3 ml krwi zawierającej heparynę lub cytrynian sodu jako antykoagulant. Wirować przy 2000 obr/min przez 10 minut i wyrzucić osocze. Przemyć czerwone krwinki trzykrotnie solą fizjologiczną (750 obr/min, każdorazowo wirować 5 minut). Wirować przy 2200 obr/min przez 10 minut i odrzucić supernatant. Dodać równą ilość wody destylowanej, następnie dodać 0,5-krotną objętość czterochlorku węgla. Wstrząsaj energicznie przez 5 minut, a następnie wiruj przy 2200 obr./min przez 10 minut, aby zebrać roztwór górnej Hb do późniejszego użycia.
Namaczanie membrany
Pociąć membranę z octanu celulozy na paski o wymiarach 3 cm x 8 cm. Namoczyć je w buforze TEB o pH 8,6 do całkowitego nasycenia, następnie wyjąć i osuszyć bibułą filtracyjną.
Plamienie
Za pomocą pipety nanieś pionowo 10 μl roztworu hemoglobiny na membranę z octanu celulozy (szorstka strona), około 1,5 cm od krawędzi.
Elektroforeza
Wlać roztwór buforu boranowego do komory elektroforezy. Umieścić membranę z octanu celulozy stroną nakrapianą na końcu komory z katodą. Uruchomić przy napięciu 200 V przez 30 minut.
Elucja
Wytnij strefy HbA i HbA2, umieść je w oddzielnych probówkach i dodaj odpowiednio 15 ml i 3 ml wody destylowanej. Delikatnie wstrząśnij, aby całkowicie wymyć hemoglobinę, a następnie wymieszaj.
Kolorymetria
Wyzerować absorbancję, stosując wodę destylowaną jako roztwór elucyjny i zmierzyć absorbancję przy 415 nm.
Obliczenie
HbA2(%) = Absorbancja probówki HbA2 / (Absorbancja probówki HbA × 5 + Absorbancja probówki HbA2) × 100%
Obliczanie wyników eksperymentów
Zakres odniesienia dla pH 8,6 Bufor TEB Elektroforeza octanu celulozy: HbA > 95%, HbA2 1% -3,1%
Notatki
Czas elektroforezy nie powinien być zbyt długi. Membrana z octanu celulozy nie powinna wysychać podczas elektroforezy. Zatrzymaj elektroforezę, gdy HbA i HbA2 wyraźnie się rozdzielą. Długotrwała elektroforeza może powodować rozproszenie pasma i rozmycie.
Unikaj stosowania zbyt dużej próbki. Nadmiar płynnej hemoglobiny może prowadzić do oderwania się paska lub niewystarczającego zabarwienia, co skutkuje fałszywie podwyższonym poziomem HbA.
Zapobiegaj zanieczyszczeniu membrany z octanu celulozy białkami.
Prąd nie powinien być zbyt wysoki; w przeciwnym razie pasma hemoglobiny mogą się nie rozdzielić.
Zawsze dołączaj próbki od zdrowych osób i niezbędne znane nieprawidłowe hemoglobiny jako kontrole.
Firma Beijing Liuyi Biotechnology produkuje profesjonalny zbiornik do elektroforezy do elektroforezy hemoglobiny jakim jest modelDYCP-38Czbiornik do elektroforezy z membraną z octanu celulozy i dostępne są dwa modele zasilaczy do elektroforezy dla zbiornika do elektroforezy z membraną z octanu celulozyDYY-2CIDYY-6Czasilanie.
Tymczasem Beijing Liuyi Biotechnology dostarcza klientom membranę z octanu celulozy, a rozmiar membrany z octanu celulozy można dostosować. Zapraszamy do poproszenia nas o próbki i więcej informacji.
Marka Beijing Liuyi ma ponad 50-letnią historię w Chinach, a firma może dostarczać stabilne i wysokiej jakości produkty na całym świecie. Przez lata rozwoju jest godny Twojego wyboru!
Obecnie poszukujemy partnerów, mile widziani są zarówno zbiorniki do elektroforezy OEM, jak i dystrybutorzy.
Jeśli masz plan zakupów naszych produktów, nie wahaj się z nami skontaktować. Możesz wysłać nam wiadomość na e-mail[e-mail chroniony]Lub[e-mail chroniony]lub zadzwoń do nas pod numer +86 15810650221 lub dodaj Whatsapp +86 15810650221 lub Wechat: 15810650221
Czas publikacji: 20 września 2023 r